3.创新药填补国内临床用药空白
(1)IND申报分析
IND是指新药临床研究审批,新药的产生需要进行两次行政审批,一是在临床研究阶段(IND申报),二是临床研究完成注册上市(NDA申报)。中国创新药的研发正处于快速发展的阶段,IND数量由2017年的236件增长至2022年的600件,复合年均增长率达20.5%。其中,2021年有496起IND事件是国产创新药。
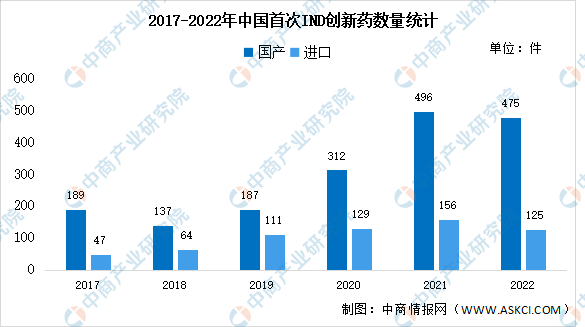
数据来源:医药魔方、中商产业研究院整理
2022年,我国首次进行IND申报的新药数量达600件,其中,国产药品475件,占比79%。国产创新药IND申报主要集中于肿瘤、血液以及免疫领域,2022年占比分别为42%、11%、6%。
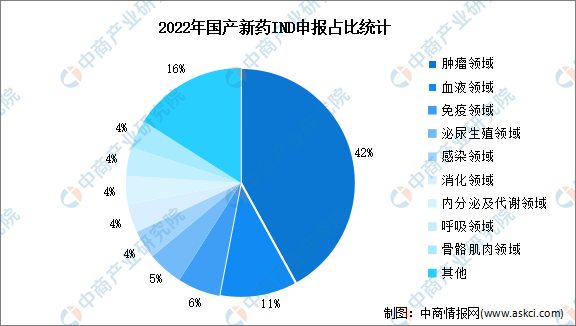
数据来源:医药魔方、中商产业研究院整理
(2)NDA申报分析
2022年,我国共有64个创新药递交了上市申请,其中国产创新药数量24个,进口创新药数量40个。数据显示,国产创新药数量自2018年开始明显增加,根据核心临床趋势,大批国产药品即将NDA。
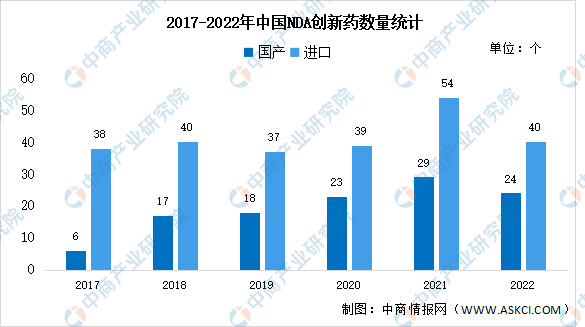
数据来源:医药魔方、中商产业研究院整理
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

